一、概述
阿片类药物是缓解中度至重度疼痛药物的重要组成部分,然而此类药物的滥用已在全球范围内成为日益严重的公共卫生问题。药物滥用是指蓄意、非医疗目的地使用(即使只有一次)具有依赖特性的药物,以达到预期的精神或生理效果。阿片类口服固体药物可能以多种方式被滥用,例如粉碎或咀嚼后服用、粉碎后鼻吸、粉碎后抽吸、粉碎溶解后注射等。采用防滥用技术可以降低药物滥用风险。
本指导原则适用于采用单独或联合使用物理/化学屏障激动剂/拮抗剂组合和厌恶剂等防滥用技术的阿片类口服固体仿制药。
对于参比制剂具有防滥用特性的,阿片类口服固体仿制药的防滥用特性应不低于参比制剂;对于参比制剂无防滥用特性的,鼓励申请人采用合理的防滥用技术研发阿片类口服固体制剂,也可以采用其他新的防滥用技术。防滥用特性是指即使不能完全避免滥用,但也显示能够有效地阻止滥用的性能。本指导原则参考相关监管机构发布的技术指导原则制定,为工业界研发和审评部门技术审评提供参考。
本指导原则仅代表药品监管部门当前的观点和认识,不具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
二、总体考虑
申请人作为申报仿制药的责任主体,应充分调研参比制剂公开信息(如国外药品监管机构审评文件、药品说明书和/或文献资料等),分析参比制剂的防滥用技术,确定说明书中的防滥用途径。
如参比制剂具有明确的防滥用特性,应对仿制药与参比制剂的防滥用特性进行对比分析评估,仿制药的防滥用特性应不低于参比制剂。申请人应基于产品防滥用特性,对比分析仿制药与参比制剂的防滥用技术及关键辅料种类和用量。建议申请人根据产品特点选择合理的防滥用技术,仿制药可采用与参比制剂不同的防滥用技术,但防滥用特性应不低于参比制剂。
阿片类口服固体仿制药防滥用特性研究开始于产品的处方工艺开发阶段,并持续贯穿于药品生命周期。
具有防滥用特性的阿片类药物属于复杂仿制药,本指导原则重点关注体外药学研究与评价,如申请人在完成体外研究后经自我评估,认为仅完成药学研究尚不充分时,可与审评机构沟通,讨论是否需进行体内研究。
三、常见的防滥用技术
(一)物理/化学屏障
物理屏障可以通过提高机械强度防止制剂被咀嚼、切割、粉碎或研磨等。化学屏障可以防止用常见溶剂如水、模拟生物介质、适宜浓度的乙醇或其他有机溶剂提取阿片类药物。物理和化学屏障可以限制机械破坏后药物释放或改变药物物理形式,从而降低阿片类药物被滥用。例如,采用聚氧乙烯辅料制成的热熔挤出片剂,可使片剂不易粉碎,遇水或乙醇后可呈黏稠状,难以提取注射。物理/化学屏障常用的辅料包括聚氧乙烯、交联丙烯酸聚合物、卡波姆、黄原胶、疏水性蜡质材料等。
(二)激动剂/拮抗剂组合
通过加入阿片受体拮抗剂可以干扰、降低或消除滥用产生的欣快感,拮抗剂可被阻隔并且仅在制剂破坏后才被释放。例如,含拮抗剂的制剂被完整吞服时,拮抗剂不发挥拮抗活性,但是在产品被粉碎后口服、鼻吸入或提取后注射时开始起作用。常用的拮抗剂包括盐酸纳洛酮、盐酸纳曲酮等。
(三)厌恶剂
厌恶剂可在制剂被破坏或超说明书允许剂量使用时,产生令人不愉快的作用。例如,防滥用制剂可在其被压碎后鼻吸入时释放刺激鼻黏膜作用的物质,以降低对滥用者的吸引力。常用的厌恶剂包括十二烷基硫酸钠等。
(四)其他
以上两种或多种技术的联合使用,或者新技术新方法。
四、评价原则
如果参比制剂具有防滥用特性,应参照以下基本原则对仿制药与参比制剂进行防滥用特性对比评估。
(一)采用逐级研究的方法
建议申请人对仿制药与参比制剂采用逐级递进的方法进行对比研究,合理确定试验数量。层级的设定需考虑滥用者处理阿片类药物操作的相似性,模拟操作的难易程度和复杂性,在处理操作的复杂性和难度逐步增加的条件下逐级评估防滥用特性。
(二)基于参比制剂防滥用特性进行评估
当评估仿制药在不同滥用途径的防滥用特性时,申请人需对参比制剂进行充分的研究,全面了解参比制剂的目标防滥用特性以及在各种潜在滥用途径下的表现特征,选取合适的质量指标对比评估仿制药与参比制剂的防滥用特性。例如,评估注射滥用途径最有意义的质量指标是阿片类药物的提取百分比。
(三)选择有效的物理处理方法
在比较仿制药与参比制剂防滥用特性之前,首先需结合产品防滥用特性选择最有效的物理处理方法。本指导原则第五部分提供了用于评估阿片类药物防滥用特性的常用物理处理方法,以及检验中如何选择最有效的物理处理方法。
(四)选择合理的体外对比研究样品
建议至少选择完整样品和经过最有效物理处理的样品。一般情况下,建议仿制药与参比制剂各取6个剂量单位(例如,片或胶囊)。对于多规格仿制药,原则上应对每个规格的仿制药与相应规格的参比制剂进行对比研究。
(五)与参比制剂进行可提取性对比研究
建议通过提取试验评估仿制药与参比制剂抵抗外力破坏的能力,比较两者的防滥用特性。本指导原则第五部分提供了提取试验的一般建议。
五、防滥用特性评估
阿片类口服固体药物潜在滥用途径主要包括鼻吸、注射、抽吸和口服。对于参比制剂说明书中具有明确防滥用途径的,申请人应评估仿制药在目标滥用途径下的防滥用特性,并与参比制剂进行对比研究,仿制药的防滥用特性应不低于参比制剂;对于参比制剂说明书中未明确的防滥用途径,申请人应对该滥用途径进行评估,提供相关研究数据,可基于风险适当简化该滥用途径的对比研究。
(一)物理处理评估和可提取性评估
1.物理处理评估
阿片类口服固体药物可被物理处理的程度取决于多个因素,包括但不限于处理方式、时间以及可使用资源等。本指导原则提供了使用现有家用设备进行物理处理的一些常用方法,申请人也可以选择其他合适的方法。通过物理处理研究,申请人可以了解制剂进行物理处理操作的难度、物理处理达到目的(如:破坏制剂完整性)的可能性及所产生颗粒大小及粒径分布等信息。
切割:如果可以用小刀或剪刀等在20℃至25℃条件下将仿制药与参比制剂在5分钟内切割成≥10小块,则无需进行冷冻或加热预处理操作;否则应增加恰当的预处理。
粉碎:如果采用家用粉碎机等可在20℃至25℃条件下将仿制药与参比制剂在5分钟内粉碎至小于1mm的颗粒>50%,则无需进行冷冻或加热预处理操作;否则应增加恰当的预处理。
研磨:如果采用家用研磨机等可在20℃至25℃条件下将仿制药与参比制剂在5分钟内研磨至小于1mm的颗粒>50%,则无需进行冷冻或加热预处理操作;否则应增加恰当的预处理。
为选择最有效的物理处理方法,可结合制剂处方工艺特点选择相应的检测指标。例如,设计为抗暴力破坏的片剂,检测指标可以选择切割、粉碎或研磨后颗粒的粒径大小,通过粒度分布数据来证明所选择物理处理方法的合理性。粒径测定可以采用含标尺的照片、图像分析技术、筛分法与激光衍射法等方法。
同时,如果经过物理处理后的样品在水中提取量增加,也可以进一步证明所选择物理处理方法的有效性。
2.可提取性评估
通过可提取性对比研究评估仿制药与参比制剂抵抗外力破坏的能力,以评估两者防滥用特性的可比性。试验样品应包括完整样品和经过最有效物理处理的样品,检测指标为阿片类药物的提取百分比,计算公式如下:阿片类药物提取百分比=(提取溶剂中阿片类药物浓度×提取溶剂体积/参比制剂标签规格)×100%。如果参比制剂是激动剂/拮抗剂组合产品,还应测定激动剂提取百分比与拮抗剂提取百分比的比值。
建议采用逐级研究的方法在20℃至25℃和溶剂沸腾条件下,采用不同层级中的所有溶剂对仿制药和参比制剂进行提取试验。随研究逐级递进,提取能力增强,申请人可根据制剂自身特点,按图1推荐的不同层级提取条件进行逐级提取试验,也可结合制剂处方工艺特点选择除推荐溶剂或组合溶剂外的其他溶剂,并提供选择依据。
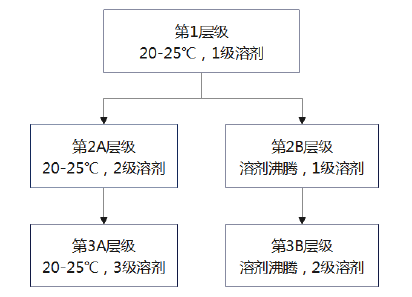
1级溶剂:水
2级溶剂:食醋,0.2%小苏打溶液,40%乙醇溶液(白酒)和碳酸饮料
3级溶剂:无水乙醇,异丙醇,丙酮,0.1mol/L盐酸溶液和0.1mol/L氢氧化钠溶液
备注:提取条件:提取溶剂240ml,20℃至25℃或溶剂沸腾,30分钟,搅拌或不搅拌。
第1层级:20℃至25℃条件下在1级溶剂中提取完整样品和经过物理处理的样品
首先应确定在20℃至25℃条件下参比制剂最有效的物理处理方法。取1级溶剂水240ml提取30分钟,如果参比制剂完整样品或经过物理处理的样品中阿片类药物提取百分比平均值≥50%,则认为参比制剂在这一层级测试中无防滥用特性,无需对仿制药和参比制剂进行对比研究;反之,若经过物理处理的参比制剂中阿片类药物提取百分比平均值<50%,则应对仿制药和参比制剂的完整样品和经过最有效物理处理的样品,分别进行最大提取百分比对比。如果仿制药最大提取百分比小于参比制剂最大提取百分比加10%,则应进行下一层级测试。例如,参比制剂最大提取百分比为25%,则仿制药的最大提取百分比应小于35%;反之,仿制药未通过该层级测试。
第2A层级:20℃至25℃条件下在2级溶剂中提取完整样品和经过物理处理的样品。
首先应确定20℃至25℃条件下参比制剂最有效的物理处理方法。取2级溶剂240ml提取30分钟,若参比制剂完整样品或经过物理处理的样品在该层级任意一种溶剂中阿片类药物提取百分比平均值≥50%,则认为参比制剂在这一层级测试中无防滥用特性,无需对仿制药和参比制剂进行对比研究;反之,若经过物理处理的参比制剂在该层级任意一种溶剂中阿片类药物提取百分比平均值均<50%,则应确定试验条件(物理和预处理方法),使仿制药完整样品和经过物理处理的样品,在所有2级溶剂中达到最大提取百分比。对仿制药和参比制剂的完整样品和经过最有效物理处理的样品,分别进行最大提取百分比对比,如果在该层级所有溶剂中仿制药最大提取百分比均小于参比制剂最大提取百分比加10%,则应进行下一层级测试。
第2B层级:溶剂沸腾条件下在1级溶剂中提取完整样品和经过物理处理的样品
采用与第1层级相同的操作步骤,在溶剂沸腾条件下使用1级溶剂对仿制药与参比制剂进行对比研究。
第3A层级:20℃至25℃条件下在3级溶剂中提取完整样品和经过物理处理的样品。
采用与第2A层级相同的操作步骤,在20℃至25℃条件下使用3级溶剂对仿制药与参比制剂进行对比研究。
第3B层级:溶剂沸腾条件下在2级溶剂中提取完整样品和经过物理处理的样品
采用与第2A层级中相同的操作步骤,在溶剂沸腾条件下使用2级溶剂对仿制药与参比制剂进行对比研究。
(二)目标防滥用特性评估
1.鼻吸
鼻吸途径滥用通常是指对经过物理处理的阿片类口服固体药物进行鼻吸。目前常见的可以减少鼻吸滥用的制剂技术主要包括:加入特定辅料增加制剂硬度以增加物理处理难度、延缓物理处理后阿片类药物的释放速率,或增加制剂尺寸以增加物理处理后粉末的量,起到稀释阿片类药物的作用。
(1)药学评估指标
结合鼻吸途径给药特点及常见制药技术,鼻吸滥用途径的药学评估指标应包括可用于鼻吸颗粒的粒径大小和重量。通常<500μm的细颗粒质量百分比可在一定程度上反映鼻吸滥用生物利用度。
(2)评估要求
如果仿制药和参比制剂经物理处理5分钟内不能被粉碎成<500μm的细颗粒,则可选择更高强度的方法,例如经热预处理后压碎、锤击或粉碎,以生成<500μm的颗粒。如果仿制药中<500μm的细颗粒质量百分比≤10%,说明仿制药不适合鼻吸,无需对仿制药和参比制剂进行对比研究;否则,应在相同操作条件下处理参比制剂,如果参比制剂中<500μm的细颗粒质量百分比≤10%,说明参比制剂比仿制药更能抵抗物理处理。如果仿制药与参比制剂中<500μm的细颗粒质量百分比均>10%,通过体外研究说明参比制剂与仿制药可能存在鼻吸滥用风险。如果参比制剂处方中含有厌恶剂,应评估仿制药是否也可降低鼻吸滥用意愿。仿制药厌恶剂种类应与参比制剂一致,且用量在95%~105%范围内。
2.注射
注射途径滥用通常是在20℃至25℃或溶剂沸腾条件下,使用少量水或其他溶剂从完整样品或经过物理处理后的样品中提取阿片类药物后采用注射器进行注射。
(1)药学评估指标
结合注射途径给药特点可知,评估注射滥用途径防滥用特性首先应评估所采用的提取溶剂是否适用于人体注射或浓缩后复溶,然后再测定可用于注射的阿片类药物的量。该可用量由阿片类药物在溶剂中的浓度(可提取性)和注射器中的吸入体积及注射器针头中排出的体积(可注射性)确定。
阿片类药物可注射量百分比是评估注射滥用途径的重要指标,计算公式如下:阿片类药物可注射量百分比=(从注射器针头中排出的阿片类药物浓度×注射器针头中排出的药液体积/参比制剂标签规格)×100%。如果参比制剂是激动剂/拮抗剂组合产品,还应测定阿片类药物可注射量百分比与拮抗剂可注射量百分比的比值。
(2)评估要求
在可提取性评估中,当参比制剂在240ml溶剂中提取30分钟,阿片类药物的最大提取百分比≥50%,或者仿制药通过了所有层级大体积溶剂(240ml)可提取性研究时(见图2),建议采用相应层级中所有溶剂的小体积溶剂(10ml)对仿制药和参比制剂进行可注射性对比研究(见图4)。经过物理处理后,建议参照以下研究条件进行可注射性对比研究:该层级中溶剂10ml,20℃至25℃或溶剂沸腾,提取5至60分钟,采用国内临床使用20G(8号)或更细的针头,如果该溶剂不适合注射或浓缩后复溶给药,则无需再进一步对比研究。
通常建议仿制药与参比制剂各取1个剂量单位(例如:片或胶囊)进行可注射性对比研究;如果该试验无法准确表征参比制剂的可注射性,则应取多个剂量单位样品进行试验,溶剂体积不变,但需证明所取样品数量能够区分仿制药与参比制剂的可注射性。
申请人应提供研究条件,包括提取时间、注射时间、针头规格和颗粒是否过滤等研究信息。
对比仿制药和参比制剂完整样品和经过物理处理后样品的最大可注射量百分比,通常如果仿制药低于参比制剂最大可注射量百分比,则证明仿制药注射途径防滥用特性不低于参比制剂。
3.抽吸
抽吸途径滥用是指将阿片类药物加热后,阿片类活性成份以盐或游离碱形式升华后被抽吸。
(1)药学评估指标
抽吸途径滥用需评估阿片类药物升华百分比(以下均指平均值),计算公式如下:阿片类药物升华百分比=(升华量/参比制剂标签规格)×100%,其中升华量是产品加热后可用于抽吸的药物量。如参比制剂为激动剂/拮抗剂组合产品,还应测定激动剂/拮抗剂升华百分比的比值。
(2)评估要求
建议申请人选择家用研磨机等研磨设备对样品进行物理处理。建议选择在200℃至300℃范围内三种不同的温度对完整的和经过物理处理的仿制药和参比制剂进行2至15分钟升华试验。
建议申请人遵循基于逐级研究的评价原则,采用不同的方法制备抽吸样品比较升华百分比。
第1层级:采用完整和经过物理处理的样品直接升华
如果物理处理5分钟后,仍无法将仿制药或参比制剂粉碎至<1mm的颗粒,可增加物理处理强度,如经热处理后再粉碎。
如果仿制药的阿片类药物升华百分比大于参比制剂的阿片类药物升华百分比,则仿制药的防滥用特性低于参比制剂;反之,如果仿制药的阿片类药物升华百分比不大于参比制剂的阿片类药物升华百分比,且经检测阿片类药物不是盐,则仿制药的防滥用特性不低于参比制剂;如果经检测阿片类药物成盐,则应进行第2层级研究。
第2层级:从完整和经过物理处理的样品中回收阿片类药物游离碱的升华
使用家用小苏打等碱性物质将成盐阿片类药物转化为游离碱,通过升华试验分别测定仿制药和参比制剂中阿片类药物的升华百分比。
如果仿制药的阿片类药物升华百分比不大于参比制剂的阿片类药物升华百分比,则仿制药的防滥用特性不低于参比制剂。反之,仿制药的防滥用特性低于参比制剂。
4.口服
口服途径滥用通常是通过物理处理(例如:切割、粉碎或研磨)或咀嚼破坏制剂的防滥用技术,导致口服滥用风险增加。对于参比制剂说明书中明确采用相关技术减少咀嚼等滥用的,或参比制剂个药指南中明确需要进行咀嚼等药代动力学研究的,建议申请人与审评机构沟通讨论相关要求。
来源:国家药品监督管理局药品审评中心